EU農薬規制:EU PPP-植物保護製品規制
EU農薬規制Regulation(EC)No 1107/2009(以下はEU PPP規制と略称する)は旧法令であるDirective 91/414/EECを取って代わって2009年に公布され、2011年6月14日から正式に実施され、現在EUにおける農薬管理の最も重要な規制である。
これに関連して、Regulation(EU)283/2013とCommission Regulation (EU)284/2013はそれぞれEU農薬活性物質と製剤製品登録のデータ要件を規定した。さらに、EU委員会EC、EU食品安全局EFSA、および各加盟国が発行した一連のガイドライン文書は、EU PPP規制を詳しく補足するものとして、具体的な登記操作の詳細問題(例えば登録プロセス、審査費用、文献検索、データ保護、リスク評価など)を詳述している。
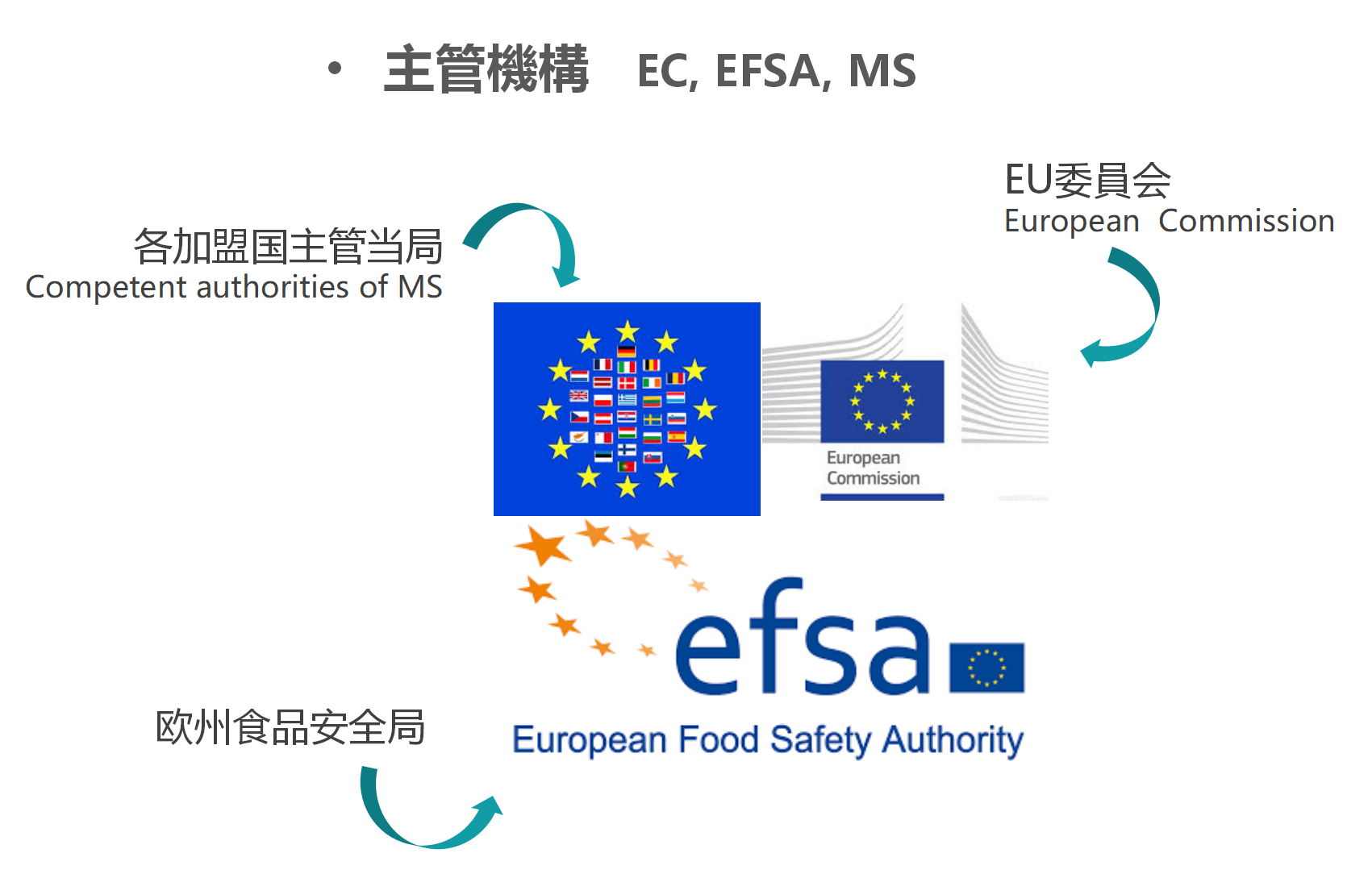
主な監督管理機関としては、EU委員会(European Commission、EC)、欧州食品安全局(European Food Safety Authority、EFSA)、及び各加盟国主管当局(Competent authorities of MS)がある。
企業の義務と対応ポリシー
登記範囲
EU PPP規制の管理範囲は農薬活性物質、安全剤、相乗剤、農薬製剤、補助剤(例えばバレル混合助剤)などを含む。
EU PPP規制によると、EUにおける農薬製品の登記は2つのレベルに分けられている。
一つはEUにおける活性物質の承認(原薬登記)
もう一つは加盟国間の製剤製品授権(製剤登記)である。

登記主体
EU内外の農薬製造業者、貿易業者など。
登記プロセス
![articles/美国-欧盟农药登记流程图-更新-自动保存-11.png 美国-欧盟农药登记流程图-更新 [自动保存]_11.png](static/picture/美国-欧盟农药登记流程图-更新-自动保存-11.png)
EU農薬活性物質の承認審査プロセス
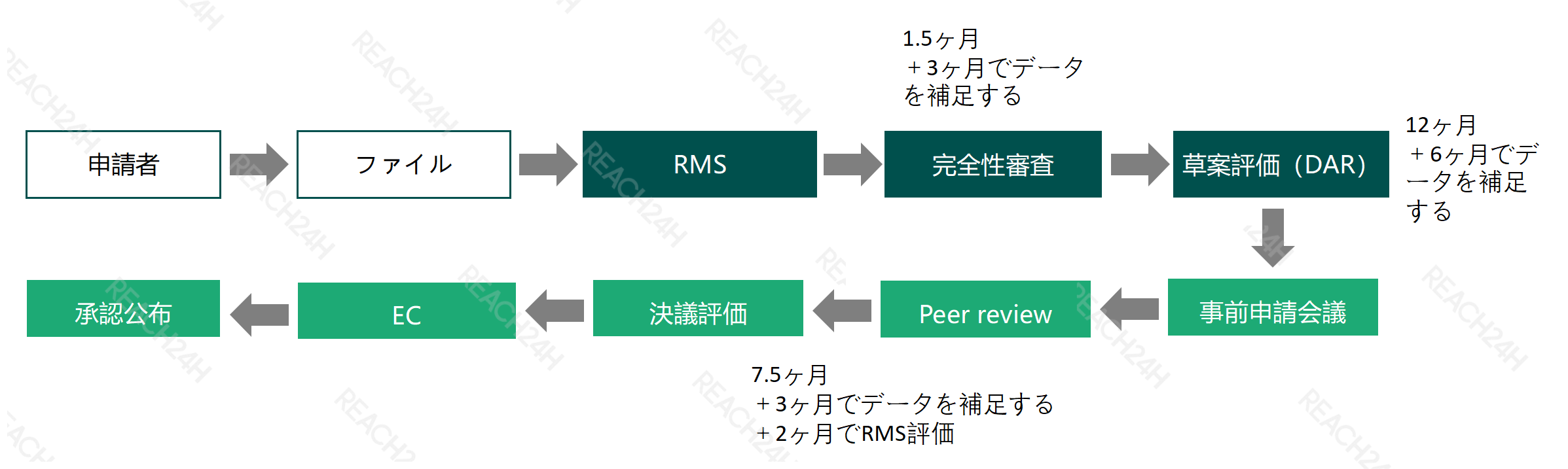
一般的に、1つの新しい農薬活性物質に対して、EUにおいては統一的に一回審査を行い、審査プロセスは以下の図の通りである:企業はまず評価加盟国(RMS)を選定し、申請のための完全なファイルを提出し、評価加盟国が評価を行い、評価報告書草案を作成する。評価報告書草案が完成した後、EFSA、EU委員会及びEUのその他の加盟国に送付し、EFSAによって評価草案の公開評価を行う。すべての加盟国が合意した後、評価結果は合格できる。そのため、物質の承認が一旦発効されると、EU全体において認可され、承認後の物質出所は原薬の参考出所となり、10年の承認有効期間を享受する。
EU原薬同等性評価(EU TE評価)
原薬の参照出所に加え、他の非特許原薬のEU市場への参入は、EUで承認された参照出所と同等性(Technical Equivalence、TE)評価を行う必要があり、EU TE評価に合格するとEUにおいて有効となり、EU市場全体への参入が可能となる。
一般的に、次の三つの異なる状況はEU TE評価を行う必要がある。
新原薬は参照出所メーカー以外のメーカーによって生産される
元参照出所或いはTE承認出所は小テスト或いは中テストから大規模生産になる
元参照出所或いはTE承認出所は生産技術や生産工場の所在地を変更した
製品授権
製剤製品の授権は加盟国間であり、製品の販売はすべての対象国の授権を取得する必要がある。
重複的な審査を減らし、製品がEU市場に投入する周期を短縮するために、EU PPP規制は地域評価システムを導入し、製品登記に対して地域審査制度を採用している。地域評価の関連規定によると、EU地域は農業気候条件によって北、中、南の3つの地域に分けられ、コアファイル地域の統一評価を実行する。コアファイルの他、関連加盟国は当国の追加データ要件(薬効果、残留、環境傾向など)を有することができる。当国の環境条件に関する追加データは加盟国ファイルに含まれ、各加盟国によって個別に審査する。農業気候条件に影響されない農薬製品、例えば屋内使用(収穫後処理、温室、倉庫)及び種子処理農薬製品の使用については、その製剤を登記する時に、EU全域を1つの地域として評価する。
企業が地域の授権を申請する時の具体的なプロセスは以下の図の通りである。製剤登記を申請する時に、製品に使用する原薬の出所は参照出所又は参照出所と同等の新しい出所でなければならない(TE出所)。また、製品授権評価の中で、製品のファイル、評価草案及び評価決定はRMSを除き、同区域内の他のすべての加盟国にも送付し、これらの加盟国の評議意見を受け入れる。これにより、1つの加盟国の製品授権を取得した後、製品を輸出する同じ地域内の他の加盟国に地域相互承認を申請することができ、製品授権の周期とコストを大幅に簡略化する。
![articles/美国-欧盟农药登记流程图-更新-自动保存-08.png 美国-欧盟农药登记流程图-更新 [自动保存]_08.png](static/picture/美国-欧盟农药登记流程图-更新-自动保存-08.png)
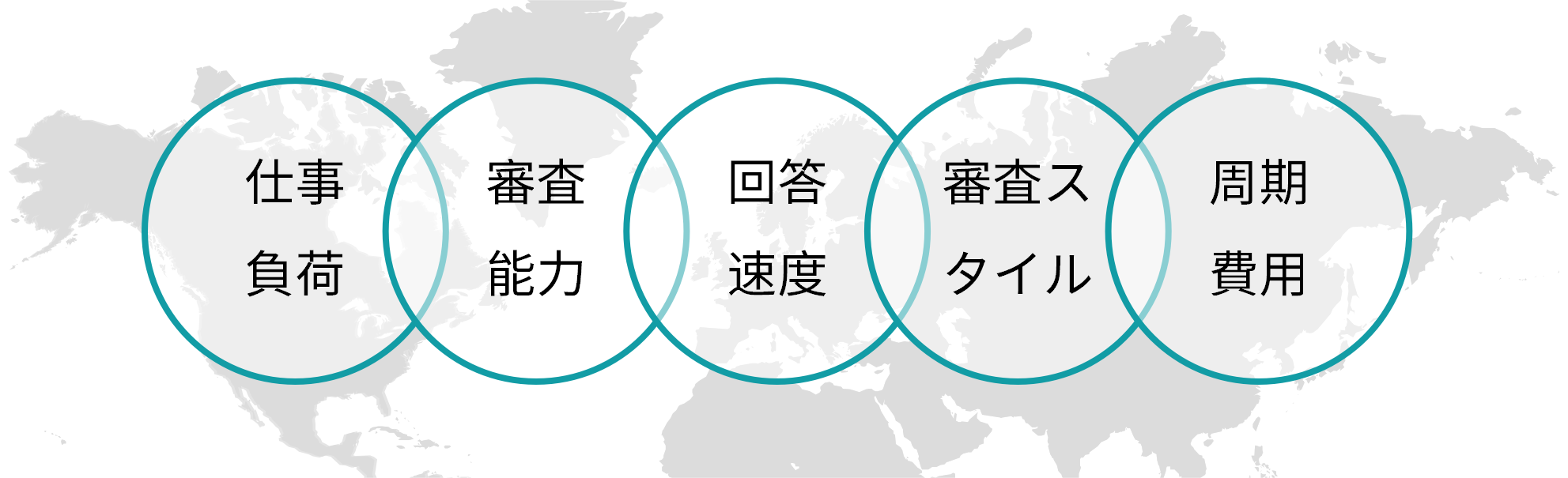
評価加盟国(RMS)選定
原薬のTE評価または製剤製品の授権を申請する時、メイン評価国(RMS)を選定する必要があり、RMS選定の主要な考慮要素は以下の通りである。
EU農薬再審査
EU PPP規制の下で、活性物質が初めて承認された後、一般的に10年の有効期限(低リスク農薬および候補代替物質を除く)を有し、活性物質の有効期限が切れる3年前に、企業は物質の再審査申請を提出する必要がある。
製品登記の有効期間は活性物質の承認状態と関係があり、活性物質が承認状態である限り、製品登記は有効である。活性物質の再審査が合格した後、該当製品も登記を更新する必要がある。
EU農薬登録データ保護
登記申請者の権益を保証するために、EUは農薬登録に用いるデータを保護している。データ保護は一般的に製剤製品の授権承認日から計算し、普通で製品の最初の批准データ(原薬承認および製剤承認データを含む)は10年の有効期間(低リスク農薬13年)を有し、再審査データは30ヶ月の有効期間を有する。
REACH24Hのサービス
EU原薬同等性評価(EU TE)
EU農薬新活性成分登記
活性物質の再審査申請
EU農薬製剤製品授権/metoo登記
QSAR報告書
内分泌かく乱リスク評価
製品コンプライアンス分析/データギャップ分析報告書
データ評価/ギャップ分析/免除分析
GLP実験代理と監督
規制総合コンサルティングとカスタム教育サービス
EU支社の設立
REACH24Hの強み
豊富なキャリア:EU農薬管理規制を長年でフォロー・研究し、国内で初めて自主的にEU農薬登記を完成したコンサルティング機関
優れたパフォーマンス:2021年11月まで、瑞欧科学技術はすでに国内外数百社の企業のためにEU TE申請を協力して成功し、関連製品は90個以上に達し、かつ100%の合格率を持っている。70%以上の中国農薬トップ100企業をサービスする
豊富な技術実力:分析化学、化学工程、生物、薬理、環境などの専門出身の中高級な技術者から構成される強大なチーム、何人かの国際認証毒物学者、リスク評価専門家を持つ。
国際化サービスレベル:英語、中国語、韓国語、日本語、スペイン語、ドイツ語などの多言語能力を持つ顧客サービス人員は、効率的に国際顧客にサービスする。
豊富な蓄積:長年にわたってEU農薬規制対応および技術コンサルティングサービスに従事している中で、豊富な経験を蓄積し、プロジェクトの難しい問題の解決に上手である。
優れた資源:国内外の多くの優秀な実験室と協力し、企業のために専門的で効率的なテスト案を設計し、良質なサービスを提供する。
良好な関係ルート:EU EFSA、イギリスHSE、オランダctgbなどの公的機構、および専門家と長期的で友好的なコミュニケーションルートを確立し、サービス品質と効率を著しく向上させる。

