規制の概要
米国における医薬品包装材料の規制モデル
FDAは、ドラッグマスターファイル(DMF)管理モデルを導入しました。 さまざまな製品ファイリングに従って分類されます。 DMF の種類ごとに異なるデータ要件があり、主に次のカテゴリに分類されます。
· クラスII - 医薬品有効成分(API中間体およびその調製または医薬品に使用される材料)
· カテゴリーIII - 医薬品包装材料
· クラスIV-医薬品賦形剤
· カテゴリーV-FDAが受け取った参照情報
米国では、輸入および国内で販売されている医薬品包装材料は、クラスIIIのDMF申請を申請できます。 一般的な技術ファイル形式の要件に従ってデータを書き込み、完全なDMFファイルに整理し、FDAに提出して電子提出の形式で提出します。
米国の規制では、医薬品包装会社にDMFの提出を義務付けておらず、FDAはこれに対して中立的な態度を維持しています。 包装材料の製造業者は、医薬品申請者に技術情報を直接提供し、医薬品申請資料に包装材料に関する情報を含めるか、関連する機密情報が下流に漏れないようにするために、材料を直接FDAに提出するDMFファイリングを選択するかを選択できます。
規制当局とその責任
米国食品医薬品局(FDA)は、米国保健社会福祉省直轄の連邦政府機関です。 FDAの監督は主に医薬品を対象としており、医薬品関連の「補助的」製品(API、医薬品賦形剤、医薬品包装材料など)は、ドラッグマスターファイル(DMF)管理モデルを通じて審査することができます。
医薬品評価研究センター(CDER)は、現在、FDA最大の審査センターであり、主に処方薬および一般用医薬品の監督、新薬およびジェネリック医薬品の市販前評価、医薬品の安全性、品質、有効性、および関連する審査に関連しています。
FDAの一部である規制局(ORA)は、規制対象製品および製造業者を検査および調査し、規制対象製品のサンプリングおよび分析を行い、米国に輸入された製品の検査、取り扱い、リコール、および施行を行います。
ICP申請プロセス
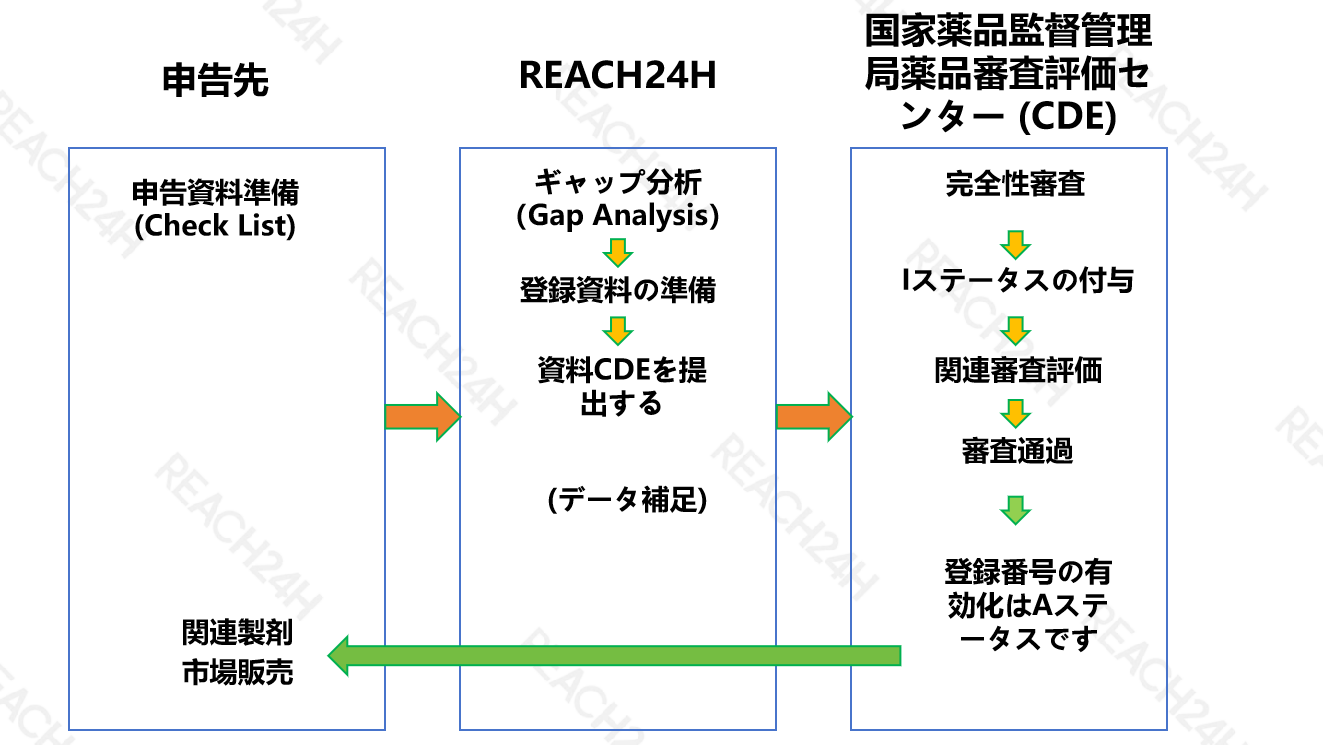
医薬品包装材料のDMFファイリング手順
· 医薬品包装材料会社は、FDAのWebサイトでDMF電子材料を提出します。
· 医薬品評価研究センター(CDER)は登録データをレビューせず、2~3週間以内にDMFレコード番号を付与します。
· CDERは医薬品と組み合わせて関連するレビューを実施し、医薬品包装材料の関連情報が不完全な場合は、完了するまで補足するように医薬品包装材料会社に通知します(医薬品包装材料会社に承認または不承認はありません)。
· 関連する審査に合格した後、医薬品包装材料企業に通知されます。
医薬品包装材料のファイリング材料
ドラッグマスターファイル(DMF)は、医薬品包装材料の一般情報、それ自体の性質、
番号 | 登録情報カテゴリー | 関連情報 |
1 | 一般情報 | 包装部品名、製品コード、物性説明(形状、サイズ、色など) |
2 | 生産情報 | 包装部品のメーカー情報 |
製造工程の説明(洗浄、殺菌、熱源除去などを含む) | ||
材料管理 | ||
必要なステップを中間物の制御 | ||
滅菌及び脱熱分解プロセスの検証 | ||
3 | 品質管理 | 品質基準(包装資材の構成図) |
分析方法と分析方法の検証 | ||
バッチ分析レポート | ||
品質基準の確立の基礎 | ||
4 | 制御物質 | 試験工程で使用される包装材料の参考資料 |
5 | 保護 | 光を避ける、公害を防ぐなど(L/S/M/W/G) |
6 | 安全性研究 | 「ケースに応じて異なるデータを提供する」 |
7 | 互換性調査 | さまざまなケースに応じてさまざまなデータを提供する |
8 | 自分自身の安定性 | 安定性の概要、データ、結論を提供する |
サービス内容
· 医薬品包装材料のDMF申請相談
· 医薬品包装材料用DMFファイリング剤
· 出願資料の翻訳
· 医薬品包装資材審査のフォローアップ
· 医薬品包装材料用DMFの年次報告書作成
· 医薬品包装材料のDMF承認書(LOA)
· DMFファイリングの終了または再開
· 実験委託・試験監理
· 公式の問い合わせと連絡
私達の利点
· 規制研究および包装材料の登録と宣言における13年以上の経験。
· 宣言に参加した包装材料には、ガラス製輸液ボトル、プラスチック製輸液ボトル、粉末液ダブルチャンバーバッグ、液液マルチチャンバーバッグ、コンビネーションキャップ、ゴム栓、イソプレンガスケット、プレフィルドシリンジ、注射バイアル、経口液体ペットボトル、経口固体プラスチックボトル、経口固体複合フィルム、プラスチックアンプル、ガラスアンプルなどが含まれます。

