背景の紹介
農薬原薬の同等性評価における(Q)SAR応用の必要性
原薬(または、原体、以下同様)の同等性認証は非特許農薬原薬が世界各国あるいは地域の市場に進出するためのファストトラックである。
現在、世界で一般的に採用されているのは2段階の原薬同等性評価プロセスであり、新規リソース(新規登録原薬)を参照リソース原薬(登録済み原薬)と比較して比べて化学成分、または、毒性が同等かどうかを評価する。
二段階の同等性評価の内、第一段階は化学評価であり、主に新規リソース中に含まれている各種不純物の構造と含有量を定性/定量することである。
第一段階の化学評価に合格できない場合、すなわち、参照リソースと比較して、新規リソースに新しい不純物が現れた、または既存の不純物の含有量が増加した場合、新規リソースが参照リソースと同等の毒性効果を有することを確保するために、第二段階の毒理学評価に入る必要がある。

EU、オーストラリア、ブラジルなどを含む国と地域は、第2段階の毒理学評価に(Q)SAR予測を導入し、主な目的は新規リソースの不純物に健康または生態に対する潜在的な毒性があるか否やを判明することである。すべての不純物(Q)SARの予測結果果が満足のいくもので、必要な毒理学実験(例えば体外遺伝毒性実験と急性毒性実験など)と合わせるか、または、危害分類とリスク評価方法を採用する場合、新規リソースと参照リソースの原薬の毒性が同じであることを十分に証明できれば、その他の毒理学実験資料を提供する必要はない。
そのため、同等性評価に(Q)SAR予測を導入することは、毒理学評価の包括性面を十分に確保できる上、高額な毒理学実験を避け、登録の所要時間を短縮することもできる。
(Q)SARの原理と方法
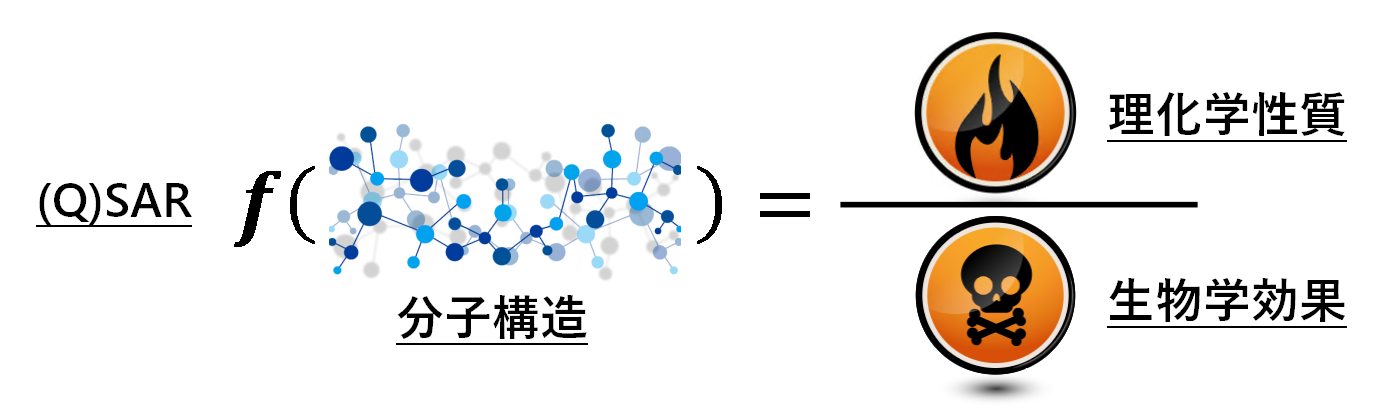
(Q)SARの基本的な仮定は、類似した構造の分子が似た性質を持つことである。定義から言えば、(Q)SARは分子構造と効果の間の定量/定性関係を記述するものであり、すなわち、我々はモデル関係を構築することによって、直接に測定対象物の分子構造に基づいて、測定対象物の効果を予測することを望んでいる。この方式の利点は試験時間が長い、且つ費用が高い伝統的な実験測定方法に依存する必要がなくなることである。
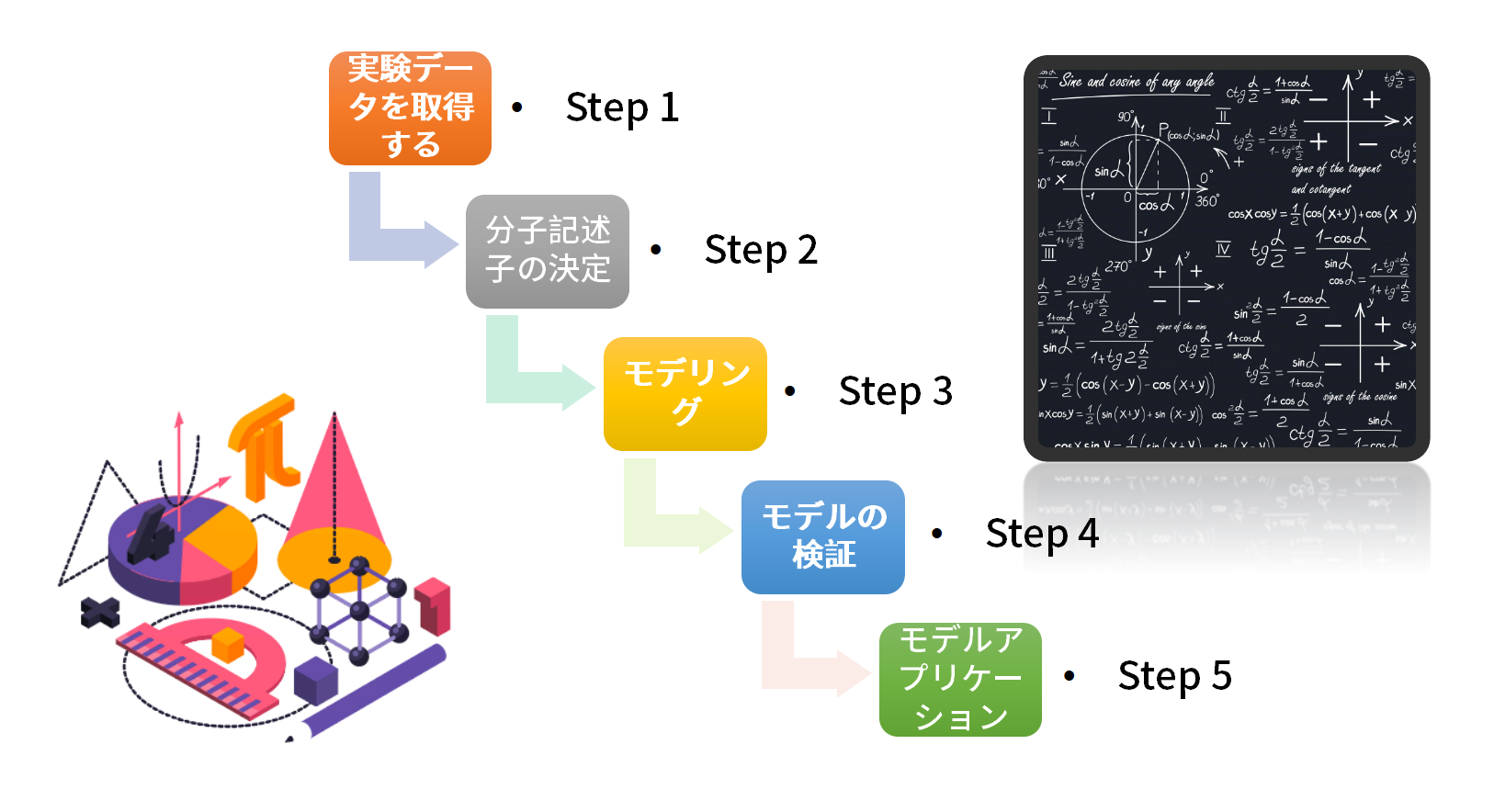
一般的に、(Q)SARモデルは以下の5つのステップで構築される:
世界の農薬法規における(Q)SARの要求
EU
EUでは、加盟国によって(Q)SAR報告の要求は異なるが、具体的な(Q)SARモデルの要求はRule-basedモデルとStatistic-basedモデルの2種類に分けられ、評価報告の中で毒理学の観点から(Q)SARの予測結果に対して解釈と説明を行う必要があり、不純物に対して相応する危害分類あるいはリスク評価を行う。一部の原薬試験データ(急性毒性試験五項目、Ames試験など)を参考にして追加説明し、不純物が関連不純物であるかどうかかを判断することもできる。同時に特に遺伝毒性、内分泌かく乱作用などに留意すべきである。
ブラジル
一般的には少なくとも3つの異なるQSARソフトウェア(Three expert systems)を使用する必要があり、(Q)SARソフトウェアの予測は催奇形性、発癌と変異原性などの必要なモデルノードをカバーしなければならず、必要に応じて内分泌かく乱作用などの他のノードかく乱を追加する必要もある。できれば(Q)SARソフトウェアですべてのノードを予測できることが望ましい.また、毒理学の観点から(Q)SARの予測結果に対して解釈と説明を行う必要がある。
オーストラリア
オーストラリアはRule-basedモデルとStatistic-basedモデルの2種類の予測結果を同時に提供することを要求しているが、EUと異なり、遺伝毒性と発癌性の評価に重点を置いて、毒理学の観点から(Q)SARの予測結果に対して解釈と説明をする必要もある。2種類の予測結果が満足の行った場合、不純物の毒性を示すAmes試験などの毒理学実験資料の提出を免除することができる。
ロシア
(Q)SARモデルを用いて必要な毒理ノードを予測し、遺伝毒性、特に変異原性を反映できる関連データノードに重点を置く必要があるが、(Q)SARモデルのタイプについては具体的に要求されていない。(Q)SARの予測結果が思わしくない場合、政府は不純物に対して直接Ames試験を行うことを要求する可能性がある。
メキシコ
(Q)SAR予測ノードは経口急性毒性(LD50)の予測のみを要求し,催奇形性,発癌性,変異原性などのほかのノードはメキシコ政府が要求しないか,適切な条件では必要ないとされているが,提供する必要がある可能性は排除できない。
使用する予測モデルの数は、結果に基づいて決定する必要がある。例えば、あるモデルで予測結果が思わしくない場合は、問題を説明するのに十分な(Q)SAR証拠が得られるまで、1つまたは複数のモデルを提供する必要がある。企業は少なくとも2つのモデルの予測結果を提供することが推奨されるが、具体的に要求を満たしているかかどうかは毒理学の原理に基づき、総合的に評価する必要がある。最後に得られたLD50の予測結果は、FAOの方法に基づいて計算し、参照リソースと比較して毒性が同等であるかどうかを判断する必要がある。
FAO/WHO
(Q)SARの応用はFAO/WHO農薬同等性評価において新たに推薦された評価方法であり、主な目的もEU同等性評価要求を参考し、不純物の遺伝毒性とその他の毒性効果を重点的に評価することである。また、Rule-basedモデルとStatistic-basedモデルの2種類のモデルを用いて(Q)SARの予測を行うことも推奨される。
(Q)SAR応用の難しさの解析
Rule-basedモデルとStatistic-basedモデルの違い
ルール・ベース・モデル(Rule-based models)は専門家の経験に基づいて構造と効果の間の関係を確立し、主に警告部分構造(structural alert)に対する識別として表現されている;
統計モデル(statistic-basedmodels)は統計モデルに基づいて構造と効果の間の関係を確立し、一般的な統計モデルには線形、KNN、ランダムフォレスト、サポートベクトルマシン(SVM)、ニューラルネットワークモデルなどがある。
(Q)SAR予測報告書のフォーマット要件
現在の全世界の農薬原薬の同等性評価において、(Q)SARモデル報告に対してREACH法規のように、(Q)SAR予測に対してQMRFとQPRF様式の報告書の提出が義務付けられていないが、この様式の(Q)SAR予測報告はOECD(Q)SARの「五準則」の要求に基づいて作成されたものであるため、適用性が高く、ほとんどの国と地域(Q)のSAR報告の要求を満たすことができる。
QPRF:(Q)SAR Model Reporting Format
QPRF:(Q)SAR Prediction Reporting Format
警告部分構造に基づくルール・ベース・モデルの予測結果については、他の様式の報告フォーマットを採用することもできるが、モデル結果を十分に検証し、具体的な毒理学評価根拠を提供しなければならない。
農薬原薬の同等性評価において、各国の審査機関が農薬同等性評価において遺伝毒性に注目する理由
農薬原薬の同等性評価において、不純物に対する遺伝毒性は常に各国の評価の重点であり、主な原因は遺伝毒性(Genotoxic)物質が毒性に関する閾値がないと考えられ、厳密に言えないが遺伝毒性化合物への暴露が存在すれば、人体に対して直接的なDNA損傷を引き起こす可能性があり、それによって、癌の誘発率が著しく高くなる。そのため、異なるソースからの原薬に含まれている不純物の含有量が極めて低くても、その遺伝毒性に対して十分に評価する必要がある。
さらなる毒理学的評価
毒理学データの検索
証拠の重み(WeightofEvidence)に基づいて、データベースシステムから関連する毒理学データを検索し、すべての毒理学データの有効性と信頼性を評価し、不純物、または、目標化合物の危害値を明確にする。
リードアクロス(Read-Across)
リードアクロス、すなわち、1つ(または複数)の化合物のノード情報から、類似の特性を有する1つ(または複数)別の化合物の同じノードを予測し、それによって試験データを置き換える。不純物または目的化合物に対して、リードアクロスは主に専門家の経験に基づいて構造類似性、代謝類似性と傾向分析の3つの方面から展開される。
毒性学的懸念閾値(TTC)
TTCは、発癌または他の毒性作用のリスクが無視できる、未研究の化合物の許容摂取量を定義するものである。TTCを確定する方法は一般的に非常に保守的であると考えられ、それは50%の腫瘍発生率(TD50)の線量を単純に百万分の一の発生率に線形外挿して得られ、しかも採用したTD50データは最も敏感な種と誘導に最も敏感な腫瘍発生部位のデータから得られている。
定量的毒性閾値の計算
農薬原薬中の不純物の合理的且つ信頼できる限度範囲をさらに得るためには、不純物自身の定量的な毒性閾値を明確にする必要があり、毒理学データの検索、リードアクロスまたは毒性学的懸念閾値(TTC)の手段で不純物の毒性の強さを定量的に示し、関連する不確実性を保守的に考え、一日の許容暴露量(PDE/ADE)または許容摂取量(AI)を算出し、不純物限度管理に用いられる。
不純物の限度管理
不純物限度管理はリスク評価の原理に基づき、不純物の有害量(定量的毒性閾値から得られる)と潜在暴露量(ADI/AOELから不純物含有量不純物を考慮して得られる)を比較し、不純物の含有量レベルが限度範囲内にあるかどうかを判断する。
内分泌かく乱作用の評価
EUの農薬と消毒剤の内分泌かく乱評価ガイドラインに基づき、Level1とLevel2試験において分子ドッキング(moleculardocking)、(Q)SAR予測などの手段で、標的化合物が潜在的な内分泌かく乱効作用を有するかどうかを評価するか、または関連するメカニズムを解明する。
皮膚感作の限定方法(OECD TG 497)
2021年6月に発表されたOECDTG497は、皮膚感作性有害転帰経路(AOP)のキーイベント(KE)に関連する3つのインビ卜口試験方法と2つの(Q)SARソフトウェアのみを使用することを規定した皮膚感作性評価のための限定方法を初めて公表し、標的化合物の皮膚感作性を標準化された手順に従って評価する。
新農薬研究開発における計算毒理学評価
農薬の研究開発中に新たに発見された活性化合物に対して、計算毒理学評価を行い、これらの化合物またはその分子フラグメントに潜在的な毒性効果があるかどうかを予測し、それによって分子設計を最適化し、新しい農薬の研究開発と発売を加速する。
REACH24Hのサービス
世界の農薬(Q)SAR予測サービス(EU、ブラジル、アルゼンチン、オーストラリア、メキシコ、ロシアなど)
証拠重み(WoE)に基づく毒理学データの検索と評価
リードアクロス(Read-Across)
定量的毒性閾値計算と不純物限度管理(TTC,PDE/ADE,AI)
内分泌かく乱効作用の評価
皮膚感作の限定方法(OECD TG 497)
新農薬研究開発における計算毒理学評価
内分泌かく乱物質のドッキング(molecular docking)
(Q)SARモデリング
REACH24Hの強み
優れた専門技術チームによる確かな技術サポート
長年にわたる全世界(Q)SAR予測と毒理学評価の実施経験により、良質な技術サービスを提供する。
2021年までに、数百通の(Q)SAR予測と毒理学評価報告書の作成経験があり、合格率は100%である。
豊富な(Q)SARソフトウェアリソースと開発チーム。
国内外の専門家と長期的且つ友好的なコミュニケーションルートを確立し、サービスの品質と効率を確保する。
有効性と信頼性のある(Q)SAR予測ソフトウェア
農薬原薬の同等性評価において、瑞欧科技は顧客に十数種類の(Q)SARソフトウェア予測と専門家評価サービスを提供することができる。同時に、予測結果の有効性と信頼性をさらに高めるために、瑞欧科技も最近、世界トップクラスの(Q)SAR予測システムDerek Nexus & Sarah Nexusを正式にリリースし、全面的に毒理学ノードに対してより質の高い評価を提供することができる。

Derek Nexusの紹介-ルール・ベース・モデル(Rule-basedmodels)
Derek NexusはEU農薬同等性評価用とその他(例えばブラジル)の国家農薬監督管理機関が推薦した(Q)SARソフトウェア予測システムであり、医薬監督管理機関FDA、EMAとNMPAにも広く採用されている。
特徴:
毒理学の専門家の数十年の経験に基づく
数百種類の警告部分構造をカバーし、芳香族アミンなどの予測困難な毒性構造を十分に最適化する。
幅広い毒理学的ノード:遺伝毒性、皮膚感作性、発癌性、生殖/発達毒性、神経毒性など
透明性が高く、すべての毒理学評価の根拠、文献の出典は入手可能。

Sarah Nexusの紹介-統計モデル(statistic-based models)
Sarah Nexusは新しい階層クラスタリングモデルSOHN方法に基づいてトレーニングセットの断片化分子構造を学習し、この機械学習方法によって目標分子における遺伝毒性に関連する構造特徴を高感度に識別できる。
特徴:
高感度の予測方法で、DerekNexusと組み合わせて使用すると、予測の有効性と信頼性が大幅に向上する。
信頼性の高い大量のAmes変異原性試験データに基づく
トレーニングセットは十分な信頼性検証に合格し、信頼できるデータソースを提供する。
透明性が高く、完全な推論プロセスを備えている。
瑞欧科技はQSARサービスにおいて経験が豊富で、関連分野の専門家を多数抱えており、すでに多くの国と地域でQSARプロジェクトを成功させており、企業にシステム的なQSARソリューションを提供し、全世界の農薬登録に対応することができる。

