法规指南
2023年3月,中国CFDI发布《药品共线生产质量风险管理指南》,要求“活性物质残留限度标准应当基于产品毒理试验数据或毒理学文献资料结合实际生产情况建立。相对于传统方法设定的限度来说,基于健康的暴露限度(HBEL)的可接受标准(如PDE值)在评估清洁残留数据时更具有科学性和优势”。
2021年2月,《APIC原料药工厂中清洁验证指南》进行了更新,指南中提出“在可以获得足够数据时,应采用基于健康的暴露限度(HBEL)(可以是ADE或PDE 值)计算最大允许残留(MACO)”。
2020年8月,WHO发布了新的清洁验证指南草案《关于在清洁验证中引入HBEL的考量》,提出需要得到以HBEL为基础的残留限度,传统的限度设置方式可能不再是可接受的,同时相关的HBEL数值、PDE报告、清洁验证和计算的结果与数据都需要完整保存。
2015年6月生效的《共用设施中不同药品生产风险识别所用基于健康的暴露限度设定指南EMA/CHMP/CVMP/SWP/169430/2012》,提出所有药品都需要得到HBEL,而且不能使用LD50作为作用起始点POD(Point of Departure)。
基本概念
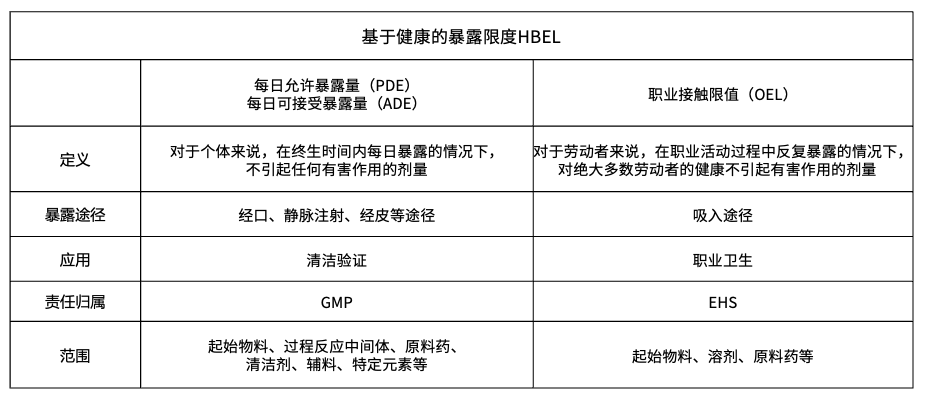 图片来源:瑞欧佰药,如需引用请标明来源
图片来源:瑞欧佰药,如需引用请标明来源
HBEL/PDE的应用
清洁验证的清洁可接受限度

设备清洁验证考虑清洁可接受限度时,活性物质残留限度标准应当基于产品毒理试验数据或毒理学文献资料结合实际生产情况建立,并在产品生命周期内进行定期评估。
评估过程应遵循HBEL、毒理学研究数据等的制定策略,并记录评估过程,包含但不限于物质毒理危害(Critical Effect)的识别、阈剂量(Point of Departure)的获取、PDE计算过程校正因子(Modification Factors)的选择、用于识别危害(Hazard Characterization)的参考文献或原始试验数据等。
传统方法 | HBEL |
1/1000最低日治疗剂量、10ppm方法,LD50推导等 | PDE、ADE等 |
一刀切,存在风险,对于某些抗生素类、细胞毒类抗肿瘤药物或高活性产品,传统限度值可能会超过PDE值,如果采用传统方法设定的限值,对患者长期暴露可能起不到充分保护 | 更具有科学性和优势 |
质量风险管理控制措施
在使用PDE或ADE值进行质量风险管理及制定技术控制措施时,按照以下危害递增原则(红色为最高危险)建立标准并对产品进行评估:

(图片源自:《药品共线生产质量风险管理指南》)
一旦完成基于健康的评估并确认HBEL,应通过质量风险管理流程使用这些数据,以确定需要实施哪些控制措施,并评估现有的组织和技术控制措施是否足够或者是否需要补充。
预计对于对患者/动物具有较高潜在危害的产品,将需要更详尽的组织和技术控制措施。
如果控制措施不能充分确保潜在污染一直控制在低于HBEL的水平,那么相关产品应在专用设施中生产。
我们的服务
PDE/ADE定制报告撰写
OEL定制报告撰写
OEB评估
PDE/ADE报告数据库
报告内容
目标化合物的识别信息、化学结构、理化性质
用途与作用机制
药代动力学、药效学、毒代动力学
动物数据危害识别,包括急性毒性、局部毒性、重复染毒毒性、生殖发育毒性、致突变性、致癌性等
人类数据的收集与审核,包括临床数据、不良反应报道、敏感人群数据等
关键作用起始点POD(PointofDeparture)的选择与识别
校正因子的选择
最终HBEL的计算结果
参考文献
我们的优势
专业的毒理学背景:拥有多名经过认证的中国毒理学家(DCST)、美国毒理学家(DABT)和欧洲注册毒理学家(ERT)团队,有丰富的数据检索能力和软件工具使用经验,可以评估多个毒理学终点(遗传毒性、重复剂量毒性、生殖发育毒性、致癌性等),涉及口服、注射、吸入、经皮等多个暴露途径。
多维度的综合服务能力:我们可以结合毒理学评估和计算结果,为客户提供毒理学测试、药品注册、GMP审核、供应商审核等多维度的延伸服务,帮助客户更好地使用相关的数据和报告,并协助客户与官方登记部门或者审核人员的沟通工作。拥有英文、日文、德文等多种语言的咨询顾问,高效服务国内外客户。






 化学品
化学品
 食品接触材料
食品接触材料
 化妆品
化妆品
 绿色双碳
绿色双碳
 境外农药登记
境外农药登记
 中国农药登记
中国农药登记