法规概述
欧盟由多个成员国组成,药品的审批程序既要考虑欧洲经济一体化的统一性,又要顾及各成员国的具体情况。根据《欧盟2001/83/EC号指令》(Directive 2001/83/EC)和《欧盟726/2004/EC号条例》( Regulation (EC) No 726/2004),欧盟市场的药品上市审评程序有以下四种情况:集中审评程序(Centralised Procedure,CP);非集中审评程序(Decentralised Procedure,DCP);互认程序(Mutual Recognition Procedure,MRP)和国家审评程序(National Procedure,NP)。四种情况各自的特点如下:
集中审评程序(CP):如果申请人想要通过一次上市注册将药品投放整个欧盟市场,可以将注册申请直接递交至欧洲药品管理局(EMA),由EMA下属的人用药品委员会(CHMP)进行评价。通过这种审批程序获得上市许可后,可以在所有欧盟成员国上市。不过,这种审评程序适用于特定的药品,如依靠生物技术以及其他高科技工艺制备研发的药品;含有新的活性成分的用于治疗艾滋病、癌症、神经退化疾病、糖尿病、自身免疫性疾病或免疫功能紊乱、病毒性疾病等疾病的药品;先进疗法药品如基因疗法药品;罕见病药物以及其他创新药品。
非集中程序DCP:如果拟上市药品在欧洲任何成员国均未得到上市许可的情况下,而申请人拟在超过一个成员国进行药品上市申请时,可按照此程序进行上市申请。申请人可选择将申请同时递交到多个拟上市成员国,并选择其中一个成员国作为参照国(RMS),则其余成员国将根据参照国的详细评估报告进行审核。仿制药可以选择按非集中审评程序申请上市,获得上市许可后可在所有申请目标成员国内进行该药品的销售。
互认程序MRP:互认程序即欧盟成员国互认程序,它基于欧盟成员国之间的互认协议。当药品已在某一个欧盟成员国获得上市许可并希望在其他目标成员国获得同样的批准时,申请人可按照互认程序向目标成员国递交上市申请。已经被授予上市许可的成员国即作为参照国(RMS),如果其他成员国在审核后承认参照国的决定,将会颁发该药品在本国的上市许可。仿制药可以选择按互认程序申请上市。
国家审评程序NP:如果药品只希望在某一成员国上市,则可以将申请资料递交至该成员国的药品管理部门,如德国的联邦药品与医疗器械研究所(BfArM)或者法国的卫生安全和健康产品委员会(AFSSAPS),各成员国按照本国的法律法规和相关技术指南进行药品申报的审评。仿制药可以选择按国家审评程序申请上市,获得上市许可后仅可在该国内进行批准药品的销售。
企业义务及应对策略
申请人根据药品情况与目标市场情况,按照欧盟及各上市国家的法规提交CP/DCP/MRP/NP申请。申请人必须具有欧洲法人资格,境外生产的可通过欧洲当地法人机构代理提交相关申请。
注册目标:获得上市许可
注册登记及流程
注册类型
符合欧洲上市相关审评程序的药品
注册资料要求
CP/DCP/MRP程序注册资料必须使用e-CTD格式递交,通过欧洲当局的CESP通道在线递交;NP程序根据当局要求递交。
注册流程
集中审评程序(CP)
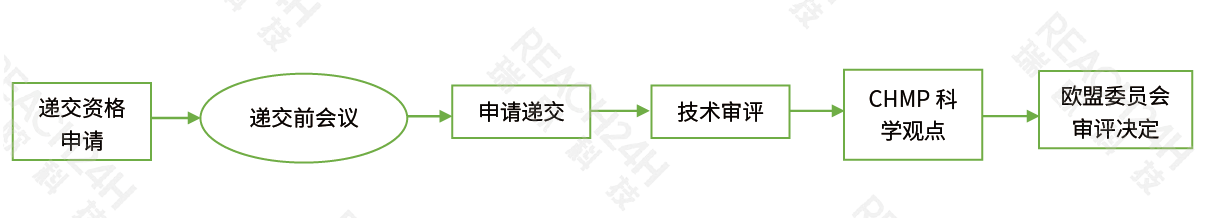
非集中审评程序(DCP)
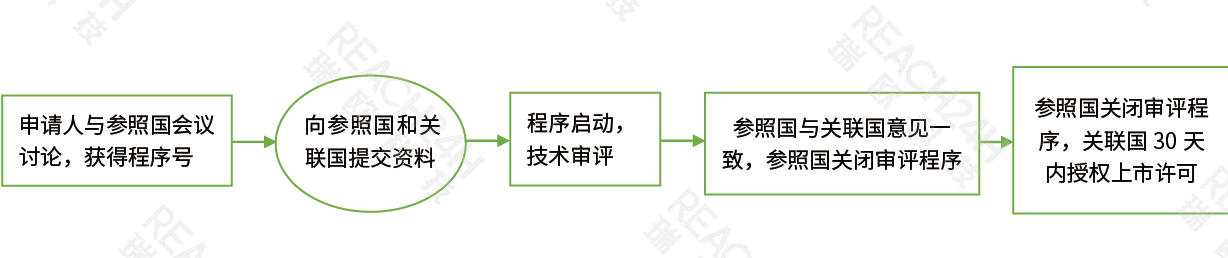
互认程序(MRP)
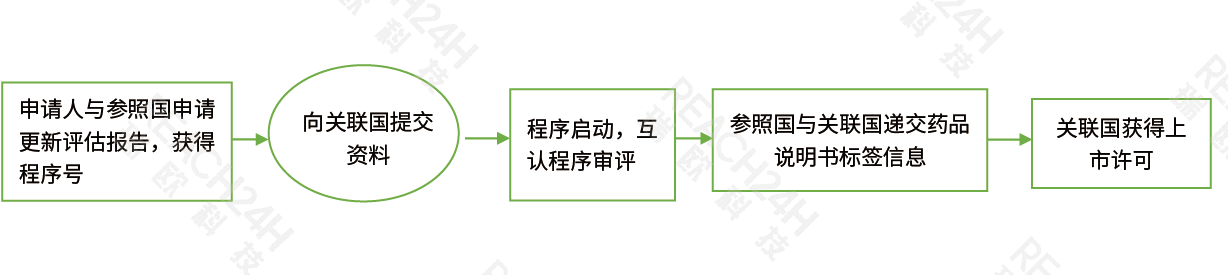
国家审评程序(NP)
需遵循目标市场国家的申报要求和时限
我们的服务
根据客户拟注册产品和目标国家,分析该品种欧洲注册程序可行性
对注册资料进行差距分析,结合品种信息进行预审,对客户提出修改建议
CTD格式注册资料的审核、翻译、编写、递交
药品注册官方审评动态全程跟踪,官方发补问题解答及补充回复资料递交。
GMP符合性预审,审查软硬件状况,指导并协助客户按时完成整改
我们的优势
专业——复合型的法规咨询团队,拥有数十年中、美、欧药品法规研究经验,确保专业的技术咨询服务
高效——项目配置专属技术与商务顾问,确保客户需求得到及时响应,竭诚为客户创造合规价值
品质——丰富的咨询项目经验和规范的服务流程管理,以及中、英、日多语言咨询服务能力,确保高品质服务过程和良好的客户体验
资源——和官方及行业专家建立长期友好的沟通渠道,显著提高服务质量和效率






 化学品
化学品
 食品接触材料
食品接触材料
 化妆品
化妆品
 绿色双碳
绿色双碳
 境外农药登记
境外农药登记
 中国农药登记
中国农药登记