法规概述
简化新药申请,即Abbreviated New Drug Application(简称ANDA)。根据美国《食品、药品和化妆品法》(The Food, Drug and Cosmetic Act)和《美国联邦管理法第21卷》(Code of Federal Regulations Title 21)等法律法规,专利期到期后的通用名药均按此程序申请上市。美国ANDA申请相当于中国的仿制药注册,走的是简化的新药注册方式。
符合ANDA申请的药品需要符合以下条件:
拟向美国食品药品监督管理局(FDA)申请ANDA的药品,需是被FDA已批准上市的,在《经治疗等同性评价批准的药品(橙皮书)》中收载并指定参比制剂的药品。如申请人拟仿制在《橙皮书》中收载但并未制定参比制剂的药品,须先提交《公民请愿书》请求FDA将该药品指定为参比制剂。
拟申请ANDA的药品,其活性成分、剂型、规格、给药途径、适应症必须与参比制剂相同,若拟申请ANDA的药品的上述条件与参比制剂不同,则需先递交有关《公民请愿书》,获得FDA批准之后,方能提出ANDA申请。
拟申请ANDA的药品,必须与参比制剂具有生物等效性。
拟申请ANDA的药品,必须按照美国联邦管理法21 CFR遵行药品生产管理规范(cGMP)控制生产过程。
企业义务及应对策略
ANDA的申请人不要求一定是公司(法人),境外申请人可通过美国代理向FDA提交ANDA申请,并保持与FDA联络,处理相关注册事宜。
注册目标:获得FDA允许上市申请的批准信。
注册登记及流程
注册类型
符合申请ANDA的药品
注册资料要求
ANDA注册资料必须使用e-CTD格式递交,可通过FDA的ESG(Electronic Submission Gateway)递交,对于超过10GB的注册资料,可用物理媒介递交,例如光盘等。
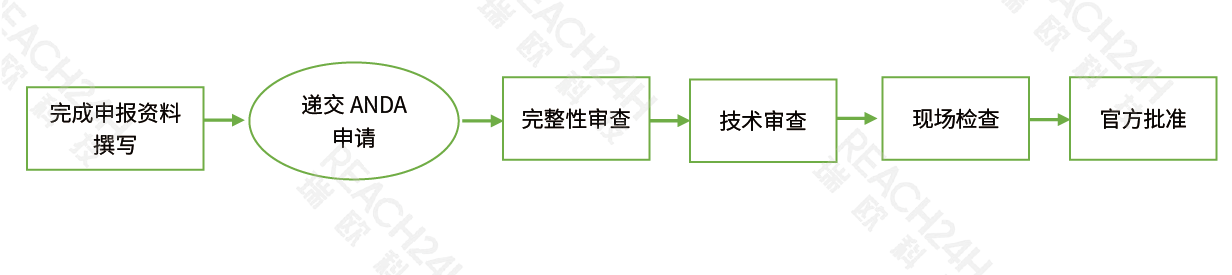
注册流程
我们的服务
根据美国法规要求,分析该品种在美国进行ANDA注册的可行性
对注册资料进行差距分析,结合品种信息进行预审,对客户提出修改建议
CTD格式注册资料的审核、翻译、编写、递交
药品注册官方审评动态全程跟踪,FDA发补问题解答及补充回复资料递交
cGMP符合性预审,审查软硬件状况,指导并协助客户按时完成整改
我们的优势
专业——复合型的法规咨询团队,拥有数十年中、美、欧药品法规研究经验,确保专业的技术咨询服务
高效——项目配置专属技术与商务顾问,确保客户需求得到及时响应,竭诚为客户创造合规价值
品质——丰富的咨询项目经验和规范的服务流程管理,以及中、英、日多语言咨询服务能力,确保高品质服务过程和良好的客户体验
资源——和官方及行业专家建立长期友好的沟通渠道,显著提高服务质量和效率






 化学品
化学品
 食品接触材料
食品接触材料
 化妆品
化妆品
 绿色双碳
绿色双碳
 境外农药登记
境外农药登记
 中国农药登记
中国农药登记