背景概述
自2020年新冠肺炎疫情爆发以来,人们的消毒防范意识不断加强,消毒产品的市场规模也在不断增长。
根据中国产业研究院公布的《2022-2027年消毒产品市场投资前景分析及供需格局研究预测报告》显示,我国消毒产品市场容量约为80-100亿元人民币,2019-2021年中国消毒产品市场规模也从110.25亿元涨至121.6亿元,可见中国消毒市场潜力巨大。
同时,随着人们环保意识的不断提高,传统消毒产品已无法满足人们的现有需求,开发和研制使用广谱性、环保型、食品级的消毒产品将是未来消毒产品发展的趋势。更加多元化的产品需求,意味着消毒产品企业要做出及时的策略调整,包括产品优化和技术革新,以应对可能发生的市场变化。
◆ 面对新形成的市场机遇,立足企业自身产品定位,以及根据国家相关法律法规要求,开展“三新”消毒产品的申报不失为一个好的选择。
“三新”消毒产品
指利用新材料、新工艺技术和新杀菌原理生产的消毒剂和消毒器械,其安全性、有效性、环境适应性等方面优于现有消毒产品。现今,“三新”消毒产品领域几乎处于空白状态,企业进行“三新”产品的申报不论成功与否,都是对自身实力的一种体现和检验。
“三新”消毒产品审批现状
区别于普通消毒产品只需在省级行政卫生部门进行备案的要求,“三新”消毒产品在其上市销售前需要向国家卫生健康委员会(以下简称“国家卫健委”)提交申请,再由国家卫健委设立的产品评审委员会对申报产品进行技术评审工作。评审通过后,才有可能获得国家卫健委颁发的卫生许可批件,所申报产品方可进行生产销售。
但“三新”消毒产品的批准通过目前来说还是十分困难的,其中存在评审体系建设有待完善(包括组建评审专家委员会、评审标准等)、申请所需资料的复杂繁多、费用和周期不明确等因素;此外,“三新”消毒产品自身在技术上的创新性,也使评审会需要对申报产品进行更为严格复杂的考察,从而导致很多申报产品都难以被予以通过。
通过国家卫健委官方网(https://zwfw.nhc.gov.cn/)查询可知,自2014年至今,没有任何一款“三新”消毒产品被予以通过,甚至很多产品都难以通过受理阶段。
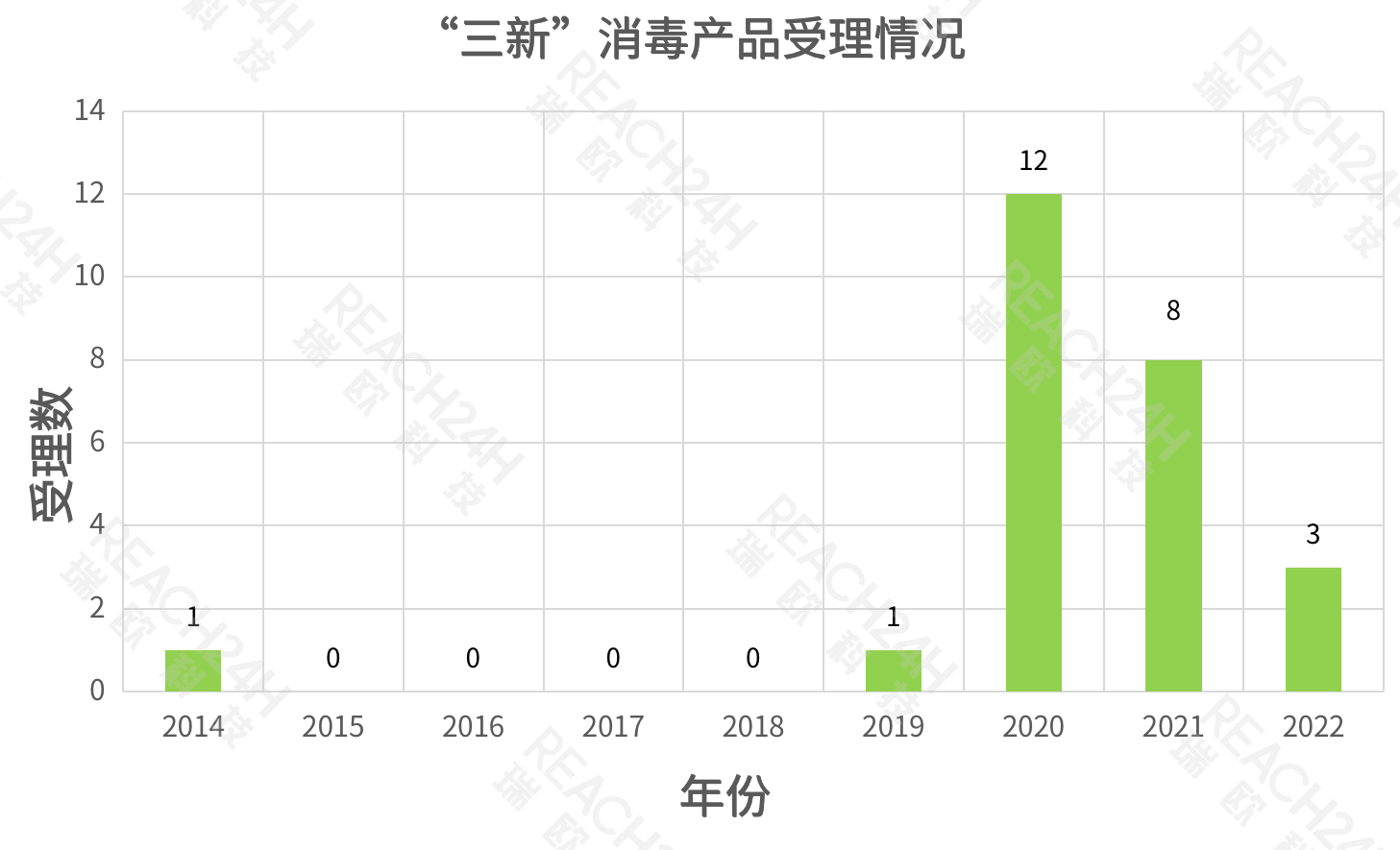
图1 2014-2022年“三新”消毒产品受理情况(数据来源:国家卫生健康委员会政务服务平台,截至2022年7月)
对此,我们对近年来被受理的“三新”消毒产品的数量进行了统计,从图1中可看出:
2015至2018年间,“三新”消毒产品的受理数为0,而2019年也仅有一款产品被受理。值得注意的是,随着2020年新冠肺炎疫情的爆发,“三新”消毒产品的被受理率大大提高,仅2020年就有12款产品通过受理,2021年也有8款产品被受理。与前几年相比,“三新”消毒产品的申请不再令人“望而生畏”,这也带给了企业更多的可能性。
此外,我们对所有被受理产品进行了整理(见表1),为有申请意向的企业提供参考。

综上可知,“三新”消毒产品申报成功不再是毫无可能,特别是在现今的大环境下。不论是对企业未来的发展规划,还是对产业技术的革新,进行“三新”消毒产品的申报都是一个不错的切入点。若申报成功通过,也是企业自身实力和能力的有力体现,建议有适合申报产品的企业不妨一试。
“三新”消毒产品合规申报
那么,企业要如何进行“三新”消毒产品的合规申报呢?
❶ 产品判断
首先,企业需要对自己的产品是否为“三新”消毒产品进行判断,即应满足“新材料、新消毒技术、新杀菌原理”这三个条件。
◆ 其中,“新材料”应同时满足三个“未列入”:
1、未列入消毒剂原料有效成分清单;
2、未列入《中华人民共和国药典》中消毒防腐类;
3、未列入现行国家卫生标准、规定。
◆ “新消毒技术”是指生产技术参数和/或工艺流程的改变,导致消毒剂和消毒器械的有效性、安全性和环境适应性等同或优于常规产品的生产加工技术。
◆ “新杀菌原理”是指未列入消毒因子及其相应消毒器械清单、指示物清单的,以物理、化学、生物消毒因子或相互协同作用产生的杀菌原理及其指示物。
可参考的法规文件有:《利用新材料、新工艺技术和新杀菌原理生产消毒剂和消毒器械的判定依据》,GB 38850-2020 消毒剂原料清单及禁限用物质以及修改单等等。
❷ 资料准备
若产品能满足以上条件的,那么就可以进入下一阶段——资料准备。
申请“三新”消毒产品需提交:申请表、省级卫生监督机构出具的生产能力审核意见、研发报告、质量标准、检测方法、产品生产国(地区)允许在当地生产销售的证明文件、在华责任单位授权书、送审样品等资料。
实际上,资料的准备和整理是一个相当庞大的工程,并不像文字描述的这么简单,一个大的资料项目下,就包含着许许多多的小项和细节规范。
★ 以新消毒剂的申请为例,仅是研制报告就需要提供国内外的研究进展报告、技术支持、研发过程、产品各种原料的CAS号、有效成分的杀菌机理、有效成分浓度及其选择过程研究报告等;制定质量标准时,还需进行各种理化试验并形成报告等;同时还需针对质量标准和产品本身进行检验方法的设置。
如此繁杂的资料准备,如果一个环节有误,则很有可能导致整个申请的失败。因此,选择有经验的第三方机构帮助企业进行申请,可达到事半功倍的效果。
❸ 卷宗递交
到此,我们的前期准备工作才刚刚结束,接下来则是资料卷宗的递交。
首先,申请人需要在国家卫健委网站上进行申请,待申请通过后,首次申报的申请人需通过预受理预审查系统提交资料。审核通过后,则需前往国家卫健委政务大厅现场提交申报材料,同时,受理部门会出具接受凭证。
若受理,受理部门将会把全套材料移交评审部门,并在60个工作日内,由评审部门组织专家对产品进行技术评审并公开征求意见。
★ 技术评审是一个无法确定周期的阶段,期间可能还会存在延期再审的情况。在这种情况下,受理部门会将评审延期通知书送达申请人,申请人则需根据通知书内容补充材料,在线提出补充材料申请后,前往政务大厅现场提交材料。
当产品通过技术评审,被建议批准时,评审部门会在20个工作日内上报国家卫健委,国家卫健委根据评审结论做出是否批准的决定,并对批准产品发布公告。
至此,“三新”消毒产品申报的整个流程才算结束。当然,这只是较为顺利的情况,在评审过程中往往伴随着多次的补充资料提交、技术检验、生产现场审查等,这也是申报企业需要做好准备的。
关于瑞欧·我们的优势
“三新”消毒产品由于其产品自身的特殊性和不确定性,以及申请过程的复杂性,使其申请难度与普通消毒产品相比大大增加,也致使很多企业不敢轻易踏足。
但随着大环境和官方态度的改变,可以想见,会有越来越多的企业愿意进行“三新”消毒产品的申报,而我们也十分愿意帮助这些企业完成他们的愿景。
深厚的资历:多年专业跟踪研究中国消毒剂产品管理法规。
卓越的表现:截止2021年11月,瑞欧科技已经成功帮助数十家国内外企业完成上百个产品的中国消毒剂产品合规。
雄厚的技术实力:拥有分析化学、化学工程、生物、药理、环境等专业背景中高级技术人员组成的强大团队。
国际化服务水平:拥有英语、汉语、韩语、日语、西班牙语、德语等多种语言能力的客户服务人员,高效服务国际客户。
丰富的积淀:在多年从事全球消毒剂法规应对及技术咨询服务过程中积累了丰富的经验。
优越的资源:和国内外众多优秀实验室合作,为企业设计专业高效的测试方案,提供优质的服务。
良好的关系渠道:和官方及专家建立长期友好的沟通渠道,确保服务质量和效率





 化学品
化学品
 食品接触材料
食品接触材料
 化妆品
化妆品
 绿色双碳
绿色双碳
 境外农药登记
境外农药登记
 中国农药登记
中国农药登记