原料药登记·背景概述
自2016年药品审评审批改革以来,我国的原料药、药用辅料和药包材逐渐进入关联审评审批阶段。
依据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》、《药品注册管理办法》、《总局关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年第146号)》和《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年 第56号)》等法律法规,原料药、药用辅料和药包材登记人可在国家药品监督管理局药品审评中心(CDE)平台进行相关资料的登记与提交。
◆ 原料药、药用辅料和药包材获得登记号后,CDE平台公示相应原料药、药用辅料和药包材的登记号、产品名称、企业名称和生产地址等基本信息。
原料药登记要求
原料药登记人依法在国家药品监督管理局药品审评中心(CDE)平台进行相关登记。
* 境内原料药生产商作为原料药登记人对所持有的产品自行登记。境外生产原料药可委托中国代理机构进行登记。
登记目标:
途径①:境内已上市原料药可申请单独审评,通过审评后登记号自动变“A”。
途径②:原料药完成平台登记后通过形式审查拿到 “I”状态的登记号,与制剂关联审评时通过技术审评,登记号的状态由“I”变为“A”。
原料药登记注册登记及流程
登记类型
在境内、境外研制和生产的原料药。
登记资料要求
原料药应符合《国家药监局关于发布化学药品注册分类及申报资料要求的通告》(2020年第44号)中的要求。
登记流程
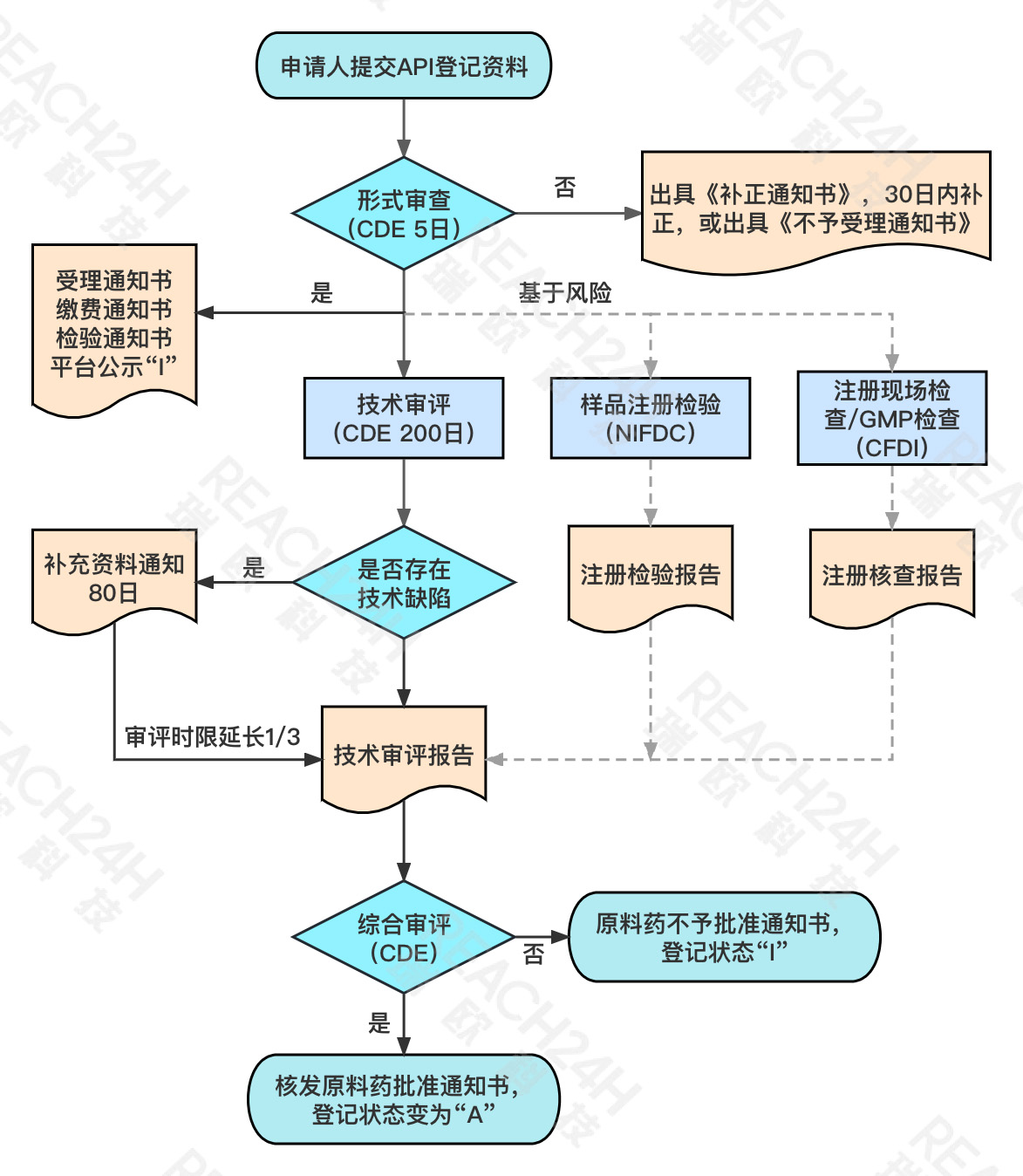
我们的服务
提供原料药申报资料大纲目录;
对登记资料进行差距分析,结合品种信息进行预审,基于制剂审评要求给与客户修改建议;
登记资料的审核、翻译、编写、递交;
原料药登记官方审评动态全程跟踪,发补问题解答及补充回复资料的递交;
原料药登记资料更新,包括重大变更、中等变更、微小变更及基础信息变更;
已登记原料药年度报告资料提交。






 化学品
化学品
 食品接触材料
食品接触材料
 化妆品
化妆品
 绿色双碳
绿色双碳
 境外农药登记
境外农药登记
 中国农药登记
中国农药登记